രസിച്ചെഴുതാം രസതന്ത്രം
Wednesday, February 12, 2020 1:10 PM IST
ഇപ്പോൾ ലഭ്യമായിരിക്കുന്ന ടൈംടേബിൾ പ്രകാരം ഈ വർഷത്തെ എസ്എസ്എൽസി പരീക്ഷയുടെ അവസാനദിവസമാണ് രസതന്ത്രത്തിനായി നീക്കിവച്ചിരിക്കുന്നത്- മാർച്ച് 26. തലേ ദിവസം പരീക്ഷ ഇല്ലാത്തതിനാൽ നന്നായി ഒരുങ്ങാനുള്ള അവസരവുമുണ്ട്.
പാഠപുസ്തകം പരിഷ്കരിച്ചതിനു ശേഷമുള്ള ആദ്യ എസ്എസ്എൽസി പരീക്ഷ ആണെങ്കിലും ചോദ്യപേപ്പറിന്റെ ഘടനയിൽ കാര്യമായ മാറ്റമില്ല. ആകെ സ്കോർ 40. പരീക്ഷാ സമയം ഒന്നരമണിക്കൂർ. തുടക്കത്തിൽ ലഭിക്കുന്ന 15 മിനിറ്റ് സമാശ്വാസ സമയത്ത് (cool - off time) ചോദ്യങ്ങൾ ശ്രദ്ധാപൂർവം വായിച്ചു മനസിലാക്കണം.
ചോദ്യത്തോടൊപ്പമുള്ള നിർദേശങ്ങൾ അനുസരിച്ചും ഓരോ ചോദ്യത്തിന്റെയും സ്കോർ പരിഗണിച്ചും സമയം ഉചിതമായി ക്രമീകരിച്ചും ചോദ്യനന്പർ കൃത്യമായി രേഖപ്പെടുത്തിയും പരീക്ഷ എഴുതുക എന്നത് ഏറെ പ്രധാനമാണ്.
ചോദ്യങ്ങളുടെ എണ്ണം, സ്കോർ
നാലു വിഭാഗങ്ങളിലായി ആകെ 20 ചോദ്യങ്ങളാണുണ്ടാവുക. ഓരോ വിഭാഗത്തിലുമുള്ള അഞ്ചു ചോദ്യങ്ങളിൽ ഏറ്റവും നന്നായി അറിയാവുന്ന നാലു ചോദ്യങ്ങൾക്ക് ഉത്തരമെഴുതിയാൽ മതിയാകും. (ആകെ 16 ചോദ്യങ്ങൾക്ക്).
ചോദ്യം 1 മുതൽ 5 വരെയുള്ള ഒന്നാം വിഭാഗത്തിൽ ഓരോ ചോദ്യത്തിനും 1 വീതമാണ് സ്കോർ. ഇവിടെ ചോദ്യങ്ങൾക്ക് a, b, c എന്നിങ്ങനെയുള്ള ഉൾപ്പിരിവുകൾ ഇല്ല. ഒരു വാക്കിലോ പരമാവധി ഒരു വാക്യത്തിലോ ഉത്തരമെഴുതിയാൽ മതി.
6 മുതൽ 10 വരെയുള്ള രണ്ടാം വിഭാഗം ചോദ്യങ്ങളിൽ ഉൾപ്പിരിവുകളുണ്ടാകും. ഓരോ ചോദ്യത്തിനും രണ്ടു സ്കോർ വീതം. 11 മുതൽ 15 വരെയുള്ള മൂന്നാം വിഭാഗത്തിൽ ഓരോ ചോദ്യത്തിനും 3 സ്കോർ വീതമാണുള്ളത്. 16 മുതൽ 20 വരെയുള്ള അവസാന സെറ്റ് ചോദ്യങ്ങളിൽ ഓരോന്നിനും 4 സ്കോർ വീതം ഉണ്ട്. ഈ രണ്ടു വിഭാഗങ്ങളിൽ ഉൾപ്പിരിവുകൾ ഉണ്ടാകും. സ്കോറിന് ആനുപാതികമായി വിശദീകരിച്ച് ഉത്തരമെഴുതേണ്ടതായിട്ടുണ്ട്.
ചോദ്യ രീതികൾ
ബ്രായ്ക്കറ്റിനുള്ളിൽനിന്നു ശരിയായ ഉത്തരം തെരഞ്ഞെടുത്തെഴുതുക, ഒറ്റവാക്കിൽ ഉത്തരമെഴുതുക, പേരെഴുതുക, വിട്ടുപോയ ഭാഗം പൂരിപ്പിക്കുക, ബന്ധം കണ്ടെത്തി പൂരിപ്പിക്കുക, ചിത്രം വിശകലനംചെയ്ത് ഉത്തരം കണ്ടെത്തുക, ശരിയായ/തെറ്റായ പ്രസ്താവനകൾ ഏതെന്ന് തിരിച്ചറിയുക, പ്രവർത്തനങ്ങളുടെ രാസസമവാക്യം എഴുതുക, കാരണം കണ്ടെത്തുക, ഗണിതപ്രശ്നങ്ങൾ നിർദ്ധാരണം ചെയ്യുക, ഫ്ളോ ചാർട്ട് പൂർത്തിയാക്കുക, ഘടനാവാക്യങ്ങൾ, സമവാക്യങ്ങൾ എന്നിവ വിശകലനം ചെയ്ത് ഉത്തരമെഴുതുക, പട്ടിക പൂർത്തീകരിക്കുക, ഇലക്ട്രോൺ വിന്യാസം ശരിയായി എഴുതുക, ഇലക്ട്രോൺ വിന്യാസം വിശകലനം ചെയ്തു തന്നിരിക്കുന്ന ചോദ്യങ്ങൾക്ക് ഉത്തരമെഴുതുക, നിർമാണ രീതികൾ, പരീക്ഷണ നിരീക്ഷണ നിഗമനങ്ങൾ തുടങ്ങിയവ വിശദീകരിക്കുക എന്നീ രീതികളിലുള്ള ചോദ്യരൂപങ്ങൾ പ്രതീക്ഷിക്കാവുന്നതാണ്.
പാഠപുസ്തകത്തിന്റെ രണ്ടു ഭാഗങ്ങളിലുമായി 7 യൂണിറ്റുകളാണുള്ളത്. ഓരോ യൂണിറ്റും വിശകലനം ചെയ്തു പ്രധാന ആശയങ്ങളും പ്രത്യേകം ശ്രദ്ധിക്കേണ്ട കാര്യങ്ങളും പരിചയപ്പെടാം.
1. പീരിയോഡിക് ടേബിളും ഇലക്ട്രോൺ വിന്യാസവും
പ്രധാന ആശയങ്ങൾ:
= ആറ്റത്തിലെ ന്യൂക്ലിയസിൽനിന്നുള്ള അകലവും ഇലക്ടോണുകളുടെ ഊർജവും തമ്മിലുള്ള ബന്ധം.
= K, L, M, N എന്നീ മുഖ്യ ഊർജനിലകളിലെയും (1, 2, 3, 4 ഷെല്ലുകൾ) അവയിലെ s, p, d, f എന്നീ ഉപ ഊർജനിലകളിലെയും (സബ്ഷെല്ലുകൾ) ഇലക്ട്രോൺ വിന്യാസം.
= ഇലക്ട്രോൺ പൂരണം നടക്കുന്ന 1 s, 2 s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f... എന്നീ ഊർജം കൂടിവരുന്ന ക്രമം.
= ഉൽകൃഷ്ട മൂലകത്തിന്റെ പ്രതീകം ബ്രായ്ക്കറ്റിൽ കാണിച്ച് സബ് ഷെൽ വിന്യാസം എഴുതുന്ന രീതി.
= സബ് ഷെൽതല ഇലക്ട്രോൺ വിന്യാസത്തിൽനിന്ന്, ബ്ലോക്ക്, പീരിയഡ്, ഗ്രൂപ്പ് എന്നിവ കണ്ടെത്തുന്നവിധം.
= മൂലകത്തിന്റെ പീരിയോഡിക് ടേബിളിലെ സ്ഥാനവും രാസസ്വഭാവവും തമ്മിലുള്ള ബന്ധം.
= s, p, d, f ബ്ലോക്കുകളിലെ പൊതുസ്വഭാവങ്ങൾ.
പ്രത്യേകം ശ്രദ്ധിക്കാം:
(1) പൊട്ടാസ്യം (19 K), കോപ്പർ (29 Cu), ക്രോമിയം (24 Cr) എന്നിവയുടെ ഇലക്ട്രോൺ വിന്യാസം.

(2) d ബ്ലോക്ക് മൂലകങ്ങളുടെ സവിശേഷതകൾ (3 മുതൽ 12 വരെ ഗ്രൂപ്പുകൾ, സംക്രമണ മൂലകങ്ങൾ, ലോഹങ്ങൾ, നിറമുള്ള സംയുക്തങ്ങൾ, വ്യത്യസ്ത ഓക്സീകരണാവസ്ഥ, ഗ്രൂപ്പിനു പുറമേ പീരിയഡിലും ഗുണങ്ങളിൽ സാദൃശ്യം)
(3) f ബ്ലോക്ക് മൂലകങ്ങൾ -ലാൻഥനോയിഡുകൾ (6-ാം പീരിയഡ്), ആക്റ്റിനോയിഡുകൾ (7-ാം പീരിയഡ്), ആണവ ഇന്ധനങ്ങൾ

(5) സംയുക്തങ്ങളുടെ രാസസൂത്രം എഴുതുക. (പോസിറ്റീവ് അയോണിന്റെ പ്രതീകം ആദ്യവും നെഗറ്റീവ് അയോണിന്റേത് രണ്ടാമതും എഴുതി സംയോജകതാ സംഖ്യകൾ പരസ്പരം മാറ്റി പാദാങ്കമായി ലഘൂകരിച്ച് എഴുതുക)
2. വാതക നിയമങ്ങളും മോൾ സങ്കല്പനവും
പ്രധാന ആശയങ്ങൾ:
= വാതകതന്മാത്രകളുടെ ക്രമീകരണം, ഊർജം-വാതക വ്യാപ്തം, സാന്ദ്രത, താപനില.
= ബോയിൽ നിയമം - PV= സ്ഥിരസംഖ്യ (മർദവും വ്യാപ്തവും വിപരീത അനുപാതത്തിൽ)
= ചാൾസ് നിയമം - V/T= സ്ഥിരസംഖ്യ (വ്യാപ്തവും താപനിലയും നേർ അനുപാതത്തിൽ.
= അവോഗാഡ്രോ നിയമം v/n= സ്ഥിരസംഖ്യ (വ്യാപ്തവും തന്മാത്രകളുടെ എണ്ണവും നേർ അനുപാതത്തിൽ)
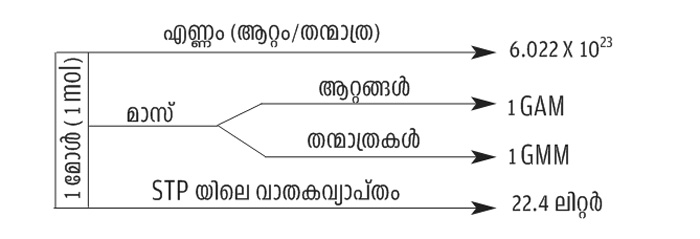
= ആപേക്ഷിക അറ്റോമിക മാസ്, ഗ്രാം അറ്റോമിക മാസ്(GAM), ഗ്രാം മോളിക്യുലർ മാസ് (GMM)
= അവോഗാഡ്രോ സംഖ്യ (NA)= 6.022x1023 = 1 മോൾ
മോളാർ വ്യാപ്തം = 22.4 ലിറ്റർ (STP യിലെ 1 മോൾ വാതകത്തിന്റെ വ്യാപ്തം)
പ്രത്യേക ശ്രദ്ധയ്ക്ക്
1. മോൾ ആറ്റങ്ങൾ = 1 GAM ൽ ഉള്ള ആറ്റങ്ങളുടെ എണ്ണം = 6.022x1023
മോൾ തന്മാത്രകൾ = 1 GMM ൽ ഉള്ള തന്മാത്രകളുടെ എണ്ണം = 6.022x1023
ഉദാ: നൈട്രജന്റെ അറ്റോമിക മാസ് 14, ഹൈഡ്രജന്റേത് 1
14 ഗ്രാം നൈട്രജൻ = 1 GAM നൈട്രജൻ = 6.022x1023 ആറ്റങ്ങൾ
= 1 മോൾ ആറ്റങ്ങൾ
N = നൈട്രജൻ ആറ്റം, N2 = നൈട്രജൻ തന്മാത്ര
28 ഗ്രാം നൈട്രജൻ = 1 GMM നൈട്രജൻ = 6.022 x 1023 തന്മാത്രകൾ
= 1 മോൾ തന്മാത്രകൾ = 2 x 6.022 x 1023 ആറ്റങ്ങൾ
= 2 മോൾ ആറ്റങ്ങൾ = 2 GAM നൈട്രജൻ
(2) മോൾ എണ്ണം കണക്കാക്കാനുള്ള മാർഗങ്ങൾ
a) കണികകളുടെ (ആറ്റം/തന്മാത്ര) എണ്ണം അവോഗാഡ്രോസംഖ്യ (6.022 x 1023)
b) ഗ്രാമിലുള്ള മാസ് GAM/GMM
c) STP യിലെ വാതകവ്യാപ്തം (ലിറ്ററിൽ) 22.4 ലിറ്റർ
(3) മോൾ, കണികകളുടെ എണ്ണം, മാസ്, വാതകവ്യാപ്തം എന്നിവ തമ്മിലുള്ള ബന്ധം
3. ക്രിയശീല ശ്രേണിയും വൈദ്യുത രസതന്ത്രവും
പ്രധാന ആശയങ്ങൾ:
= ജലം, വായു, ആസിഡ് എന്നിവയുമായി വ്യത്യസ്ത ലോഹങ്ങളുടെ പ്രവർത്തനം
= ക്രിയാശീല ശ്രേണി (രാസപ്രവർത്തനശേഷി കുറഞ്ഞുവരുന്നതിനനുസരിച്ചു ചില ലോഹങ്ങളെ ക്രമീകരിച്ച ശ്രേണി)
= ആദേശ രാസപ്രവർത്തനങ്ങൾ (ക്രിയാശീലം കൂടിയ ലോഹം, കുറഞ്ഞ ലോഹത്തെ അതിന്റെ ലവണലായനിയിൽനിന്ന് ആദേശം ചെയ്യുന്നു)
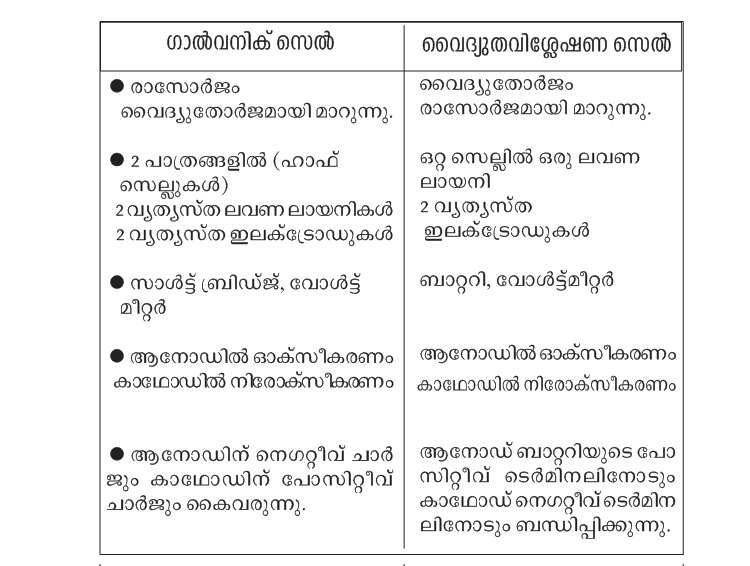
= ഗാൽവനിക് (വോൾട്ടായിക്) സെൽ (രാസോർജം വൈദ്യുതോർജമാക്കുന്നു)
= വൈദ്യുത വിശ്ലേഷണ സെൽ (വൈദ്യുതോർജം ഉപയോഗിച്ചു രാസമാറ്റം)
= ആനോഡ് (ഓക്സീകരണം നടക്കുന്ന ഇലക്ട്രോഡ്) കാഥോഡ്
(നിരോക്സീകരണം നടക്കുന്ന ഇലക്ട്രോഡ്) ഇലക്ടോലൈറ്റ് (വൈദ്യുതി കടന്നുപോകുന്പോൾ രാസമാറ്റത്തിനു വിധേയമാകുന്ന പദാർഥം)
= ഉരുകിയ NaCl ന്റെ വൈദ്യുതവിശ്ലേഷണം - ഉത്പന്നങ്ങൾ- കാഥോഡിൽ സോഡിയം, ആനോഡിൽ ക്ലോറിൻ.
= സോഡിയം ക്ലോറൈഡ് ലായനിയുടെ വൈദ്യുതവിശ്ലേഷണം
(ആനോഡിൽ ക്ലോറിൻ, കാഥോഡിൽ ഹൈഡ്രജൻ)
= വൈദ്യുതവിശ്ലേഷണത്തിന്റെ പ്രായോഗിക ഫലങ്ങൾ (ലോഹനിർമാണം, അലോഹനിർമാണം, സംയുക്തങ്ങളുടെ നിർമാണം, ലോഹശുദ്ധീകരണം)
= ഇലക്ട്രോ പ്ലേറ്റിംഗ് (വൈദ്യുതവിശ്ലേഷണംവഴി ഒരു ലോഹത്തിനുമേൽ മറ്റൊരു ലോഹത്തിന്റെ ആവരണമുണ്ടാക്കുന്ന പ്രവർത്തനം)
പ്രത്യേക ശ്രദ്ധയ്ക്ക്
1) ഓക്സിഡേഷൻ നന്പർ എഴുതി ഓക്സീകാരി, നിരോക്സീകാരി, ആനോഡ്, കാഥോഡ് എന്നിവ കണ്ടെത്തുക.
2) വ്യത്യസ്ത ലവണലായനികളിൽ വ്യത്യസ്ത ലോഹദണ്ഡുകൾ ഇറക്കിവയ്ക്കുന്നു. ആദേശം നടക്കുന്നതെവിടെ, നടക്കാത്തതെവിടെ. കാരണം?
3) ഗാൽവനിക് സെല്ലിന്റെ ചിത്രം - ആനോഡ്, കാഥോഡ്, ഹാഫ്സെല്ലുകൾ, സാൾട്ട് ബ്രിഡ്ജ്, വോൾട്ട് മീറ്റർ, ഇലക്ട്രോൺ പ്രവാഹദിശ, ലവണ ലായനികൾ.
4)
ഇലക്ട്രോപ്ലേറ്റിംഗ് നടത്തുന്പോൾ-
ഏതു ലോഹത്തിൻമേലാണോ ആവരണം ചെയ്യേണ്ടത് ആ ലോഹം (കാഥോഡ്) ബാറ്ററിയുടെ നെഗറ്റീവ് ടെർമിനലിനോടും പൂശേണ്ട ലോഹം (ആനോഡ്) ബാറ്ററിയുടെ പോസിറ്റീവ് ടെർമിനലിനോടും പൂശേണ്ട ലോഹത്തിന്റെ ലവണ ലായനി ഇലക്ട്രോലൈറ്റ് ആയും എടുക്കുക.
4. ലോഹനിർമാണം
പ്രധാന ആശയങ്ങൾ
= ധാതുക്കൾ (Minerals) , അയിരുകൾ (ores) - ഉദാഹരണങ്ങൾ
= അയിരിനുണ്ടായിരിക്കേണ്ട ഗുണങ്ങൾ.
= ലോഹനിഷ്കർഷണത്തിന്റെ (Metallurgy) 3 ഘട്ടങ്ങൾ.
= അയിരുകളുടെ സാന്ദ്രീകരണ((Concentration)ത്തിനുള്ള നാലു രീതികൾ.
= അയിരിൽനിന്ന് ലോഹത്തെ വേർതിരിക്കുന്നതിനുള്ള (Extraction) 2 ഘട്ടങ്ങൾ.
= ലോഹശുദ്ധീകരണ (Refining) മാർഗങ്ങൾ.
= ഇരുന്പിന്റെ വ്യാവസായിക നിർമാണം - ബ്ലാസ്റ്റ് ഫർണസ്
= അലോയ് സ്റ്റീലുകൾ - ഘടകങ്ങൾ, പ്രത്യേകതകൾ, ഉപയോഗം.
= അലുമിനിയത്തിന്റെ നിർമാണത്തിലെ 2 ഘട്ടങ്ങൾ.
പ്രത്യേക ശ്രദ്ധയ്ക്ക്
1. അയിരിന്റെയും അപദ്രവ്യങ്ങളുടെയും സ്വഭാവത്തിനനുസരിച്ച് ഉചിതമായ സാന്ദ്രണരീതി തെരഞ്ഞെടുക്കൽ - ജലപ്രവാഹത്തിൽ കഴുകിയെടുക്കൽ, പ്ലവനപ്രക്രിയ, കാന്തികവിഭജനം, ലീച്ചിംഗ്.
2. കാൽസിനേഷൻ (വായുവിന്റെ അസാന്നിധ്യത്തിൽ അയിരിനെ ചൂടാക്കുന്നു). ഉദാ: കാർബണേറ്റ്, ഹൈഡ്രോക്സൈഡ് റോസ്റ്റിംഗ് (വായുവിന്റെ സാന്നിധ്യത്തിൽ ചൂടാക്കുന്നു.
(ഉദാ: സൾഫൈഡ്).
3. ലോഹശുദ്ധീകരണത്തിനുള്ള ഉരുക്കി വേർതിരിക്കൽ (കുറഞ്ഞ ദ്രവണാങ്കമുള്ള ടിൻ, ലെഡ്). സ്വേദനം (കുറഞ്ഞ തിളനിലയുള്ള സിങ്ക്, കാഡ്മിയം, മെർക്കുറി).
4. വൈദ്യുതവിശ്ലേഷണ രീതിയിലുള്ള ലോഹശുദ്ധീകരണം.
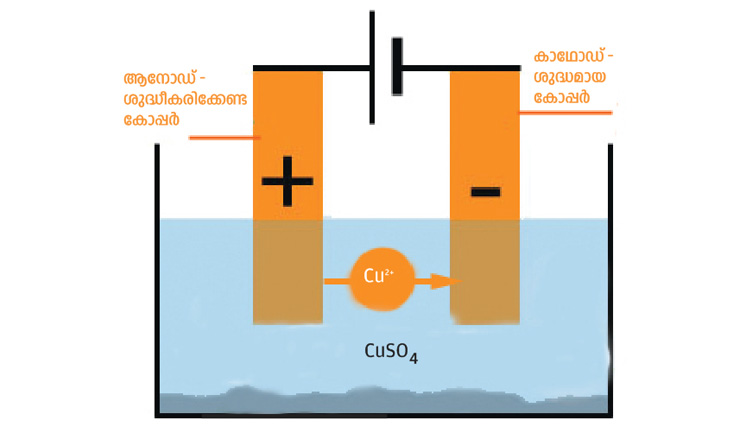
ഉദാ: കോപ്പറിന്റെ ശുദ്ധീകരണം
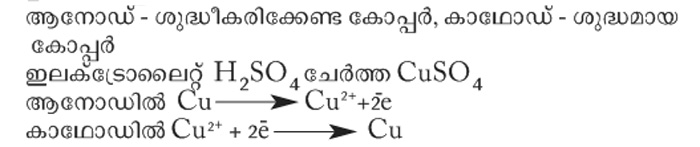
ആനോഡിൽനിന്നു കോപ്പർ അയോണുകൾ ലായനിയിലെത്തുന്നു. ലായനിയിലെ കോപ്പർ അയോണുകൾ ഇലക്ട്രോണുകളെ സ്വീകരിച്ച് കോപ്പർ ആറ്റങ്ങളായി കാഥോഡിനെ പൊതിയുന്നു. ആനോഡ് ശുഷ്കിക്കുന്നു. കാഥോഡ് വലുതാകുന്നു.
ബ്ലാസ്റ്റ് ഫർണസിലെ അയിര് (ഹേമറ്റൈറ്റ്), ഫ്ളക്സ് (കാൽസ്യം ഓക്സൈഡ്), നിരോക്സീകാരി (കാർബൺ മോണോക്സൈഡ്), ഗാങ് (SiO2), സ്ലാഗ് (കാൽസ്യം സിലിക്കേറ്റ്).
അലുമിനയുടെ വൈദ്യുതവിശ്ലേഷണം - ചിത്രം, ആനോഡ്, കാഥോഡ്, പ്രവർത്തനം
ബോക്സൈറ്റിന്റെ സാന്ദ്രണം - ഫ്ളോ ഡയഗ്രം.
ബാബു ടി. ജോൺ
അസ്ത്രാ അക്കാഡമി, കാഞ്ഞിരപ്പള്ളി.